「私の論文」
私の現在の研究の原点となった論文とその論文に至る経緯を紹介したい。
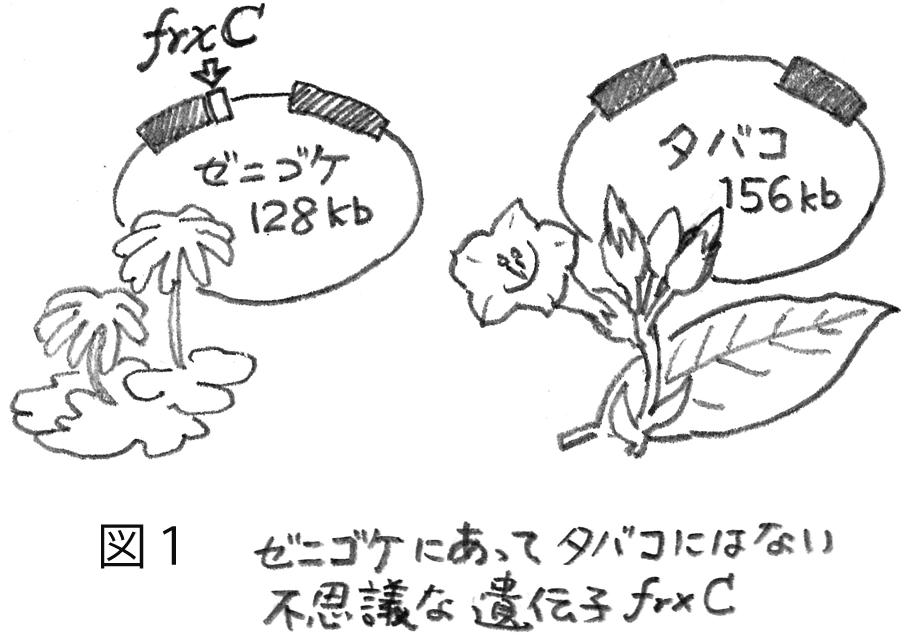
1986年、光合成の分子生物学的研究にとって歴史的な成果が相次いで日本から報告された。ゼニゴケとタバコの葉緑体DNAの全塩基配列決定である。この年の7月のある日、当時修士1年であった私に松原央教授から新しい研究課題が提示された。ゼニゴケの葉緑体DNAに、ニトロゲナーゼのFe タンパク質とアミノ酸配列で約30%という有意な類似性を示す機能未知の遺伝子が見つかった。ニトロゲナーゼは、分子状窒素をアンモニアに変換する酵素であり、限られた原核生物にだけ分布している。ニトロゲナーゼと類似性を示すタンパク質が葉緑体においてどのような生理機能をもつのか、その解明が私の大学院でのテーマとなった。この遺伝子は、暫定的にfrxCと呼ばれていた。葉緑体DNAは系統的にかなり離れたゼニゴケとタバコ間でも高い保存性を示す。ところが、不思議なことに、タバコ葉緑体DNAにはfrxCに当たる遺伝子が見つからなかった(図1)。frxCの機能解明は、この分布の違いも説明できることが期待された。
frxCの機能に迫るためには、この遺伝子を欠損した変異株の形質解析が必要である。まさに逆遺伝学的手法である。1990年前後、相同組換えを利用した特定遺伝子の破壊は酵母などでは確立されていたが、光合成生物においてこの手法はまだ黎明期であった。今でこそ、ヒメツリガネゴケやゼニゴケにおいても葉緑体DNAの形質転換系が確立されているが、当時ゼニゴケ自体を使ってfrxC欠損株を単離することは不可能と思われた。そこで、葉緑体のモデルとして注目されつつあったシアノバクテリアを使うことにした。しかし、シアノバクテリアといっても多種多様なシアノバクテリアの中でどの種を材料とすればよいのだろう?自然にDNAを取り込む性質があるSynechocystis sp. PCC 6803やSynechococcus elongatus PCC 7942を活用して特定遺伝子の破壊株の単離が報告され始めていた。ところが、私は、たまたま研究室で培養されていたシアノバクテリアPlectonema boryanum(現在Leptolyngbya boryanaと改名されている)を使うことにした。なぜこの材料にこだわったのか。P. boryanumは、完全暗所でも従属栄養的生育が可能であると報告されており、もしfrxCが光合成に必須の機能を有していても、従属栄養的条件であれば欠損株が単離可能かもしれない。しかも窒素固定能をもつことから、frxCが窒素固定と関係があるかどうかも明瞭に示すことができるかもしれない。この考えのもと、P. boryanumのゲノムからfrxCと合わせて、frxCと類似性を示すニトロゲナーゼFe タンパク質をコードするnifHもクローニングした(Fujita et al. (1991) Plant Cell Physiol. 32:1093)。
こうした経緯でシアノバクテリアを使ったfrxCの機能解析を始めたのだが、P. boryanumの形質転換系は自分で確立するほかなかった。博士課程に進学した私は、日本発の新しい実験系を確立してみたいという思いに燃えていた。別の研究室の後輩から「電気穿孔法はセルを選ばず」と聞いたことが大きな励みとなり、電気穿孔法(エレクトロポレーション法)を試してみることにした。とはいえ、もしfrxCが生育に必須の遺伝子であれば、欠損株の単離自体できない可能性がある。このため、もし欠損株が取れない場合には、電気穿孔法の条件がよくないのか、遺伝子の必須性によるものなのか判断がむずかしくなる。そこで、frxCとともにクローニングしていたnifHを電気穿孔法の条件検討に利用することにした。ニトロゲナーゼなら欠損しても硝酸塩を加えた培地であれば生育することが確実である。電気パルスをかけて(図2)選択寒天培地にまいたP. boryanumの細胞(糸状体)が生育してくるかどうか、毎日のように実体顕微鏡でシャーレの隅々まで観察していたことが思い出される。最終的に、nifH欠損株の単離を通して形質転換系を確立し、ついにfrxC欠損株を得ることに成功した。
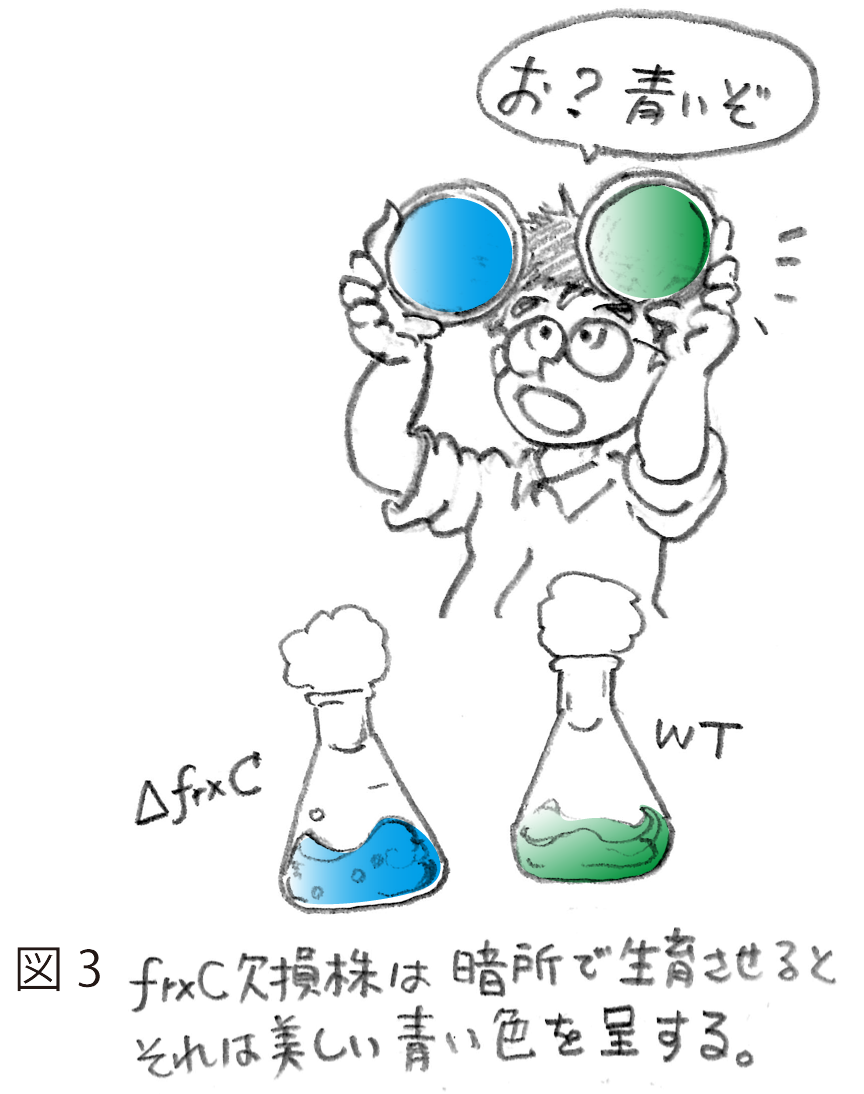
しかし、問題はこれからであった。単離されたfrxC欠損株は、明条件において光合成的に野生株とまったく変わらず生育することができ、また、窒素固定条件でも良好に生育した。すなわち、frxCは光合成にも窒素固定にも必須ではないことが早々に示された。これにはかなり落胆した。なかば諦めかけていたが、P. boryanumにこだわった主な理由である暗所での従属栄養能。これが唯一残された培養条件であった。グルコースを含む寒天培地に変異株と野生株を植菌し、アルミホイルでくるみ、培養を開始した。暗所での従属栄養的生育は遅い。3週間近くたっておそるおそるアルミホイルを開いてみた。ん?青い。変異株は野生株の緑色に比べると明らかに青い(図3)。これは何を意味するのか?さっそくこの青っぽい細胞から色素をメタノールで抽出し、吸収スペクトルをとってみてさらに驚いた。変異株にはほとんどクロロフィルが含まれていなかった。シアノバクテリアは、緑色のクロロフィルに加えて、補助色素として青いフィコビリンを有する。暗所で生育した変異株は、このうちクロロフィルだけがなくなりフィコビリンが残ったため青く見えたのである。
解析を進めると、クロロフィルの代わりにプロトクロロフィリド(Pchlide)という生合成中間体が蓄積していることもわかった。つまり、暗所でのみクロロフィル生合成がPchlideの段階で停止する。これがfrxC欠損株の形質であった。Pchlideは、暗所で黄化した被子植物が蓄積するクロロフィル生合成中間体として知られている。被子植物は、触媒作用に光を要求する光依存型Pchlide還元酵素(Light-dependent Pchlide oxidoreductase; LPOR)のみを用いてクロロフィルを生合成している。このため暗所ではPchlideの段階でクロロフィル生合成が停止し、黄化してしまう。シアノバクテリアのfrxC欠損株はあたかも被子植物のような形質を示したことになる。
この形質解析をもとに、frxCによってコードされるFrxCタンパク質は、暗所でも機能する光非依存型Pchlide還元酵素(暗所作動型Pchlide還元酵素、Dark-operative Pchlide oxidoreductase; DPOR)に関与すると結論づけた。この結果には多くの示唆が含まれていた。まず、ニトロゲナーゼと類似した酵素がクロロフィル生合成におけるPchlide還元に関与していることは、酵素の進化、光合成の進化を考える上でたいへん興味深い。また、シアノバクテリアは、DPORとLPORという2種類のPchlide還元酵素を用いてクロロフィルを生合成していることがわかった。このため、たとえDPORが欠損しても明所ならLPORによって被子植物のようにクロロフィルを作ることができる。LPORは、それまで真核光合成生物固有の酵素と思われていたが、frxC欠損株の形質は、原核生物であるシアノバクテリアがLPORを有することを初めて実験的に示すものであった。そして何より、当初の研究目的、ゼニゴケ葉緑体DNAにおけるfrxCの機能が、クロロフィル生合成であったとは驚きであった。タバコ葉緑体DNAに存在しないことは、被子植物が暗所で緑化する能力を欠いていることとよく付合している。これらの結果をまとめて上記の論文として発表することができた。その後、frxCは、光合成細菌で同定されたオルソログbchLに合わせてchlLと呼ばれることとなった(Suzuki and Bauer (1992) Plant Cell 4: 929-940)。
被子植物は暗所では緑化できずモヤシになってしまうが、光合成生物全体を見渡すと光依存的な緑化を示す生物の方が、むしろ少数派である。光合成細菌やシアノバクテリアを始め緑藻や多くの裸子植物は、暗所でも緑化することができる。暗所における緑化の研究は、1900年に掲載されたドイツ語の論文 (Burgerstein (1900) Ber. Dtsch. Bot. Ges. (Bot. Acta) 18: 168-184)までさかのぼることができる。この論文では、被子植物とは異なり、多くの裸子植物が暗所でも緑化できることを報告している。frxCの機能同定は植物科学の長年の謎の一つを明らかにするものでもあった。
私は、この研究を基点に、DPORの他の2つのサブユニット遺伝子(chlN, chlB)の同定・LPOR遺伝子(por)の同定・DPORとLPORの機能分化・DPOR活性の再構成・生化学的解析、そしてその結晶構造解明と、20年以上かけて研究を進展させていくことができた。結晶構造解析の結果、DPORは、ニトロゲナーゼと一次構造のみならず立体構造的にもたいへんよく似ており、ニトロゲナーゼと共通の構造基盤を有することが判明した。また、構造に基づき立体特異的な反応機構を提唱することができた(Muraki et al. (2010) Nature 465:110-114)。
大学院生の時にこのような研究の原石に巡り会えたことに感謝している。また、地道な研究を暖かく支えていただいた多くの方々、特に大学院で直接指導していただいた高橋康弘氏(埼玉大)、その後の研究をさまざまな側面から支えていただいた長谷俊治氏(大阪大)、小俣達男氏(名古屋大)、寺内一姫氏(立命館大)に感謝したい。