「私の論文」
1.はじめに
現役の研究から遠ざかること12年余り。「私の論文」について今語るのは重荷でもあります。
が、記憶の残っているうちに忘れがたい一つの区切りになった私たちの共著論文を紹介します。セピア色したわが研究の一歴史です。
A response-regulator homologue possibly involved in nitrogen signal transduction mediated by cytokinin in maize.
Hitoshi Sakakibara, Megumi Suzuki, Kentaro Takei,Atsushi Deji, Mitsutaka Taniguchi and Tatsuo Sugiyama
The Plant Journal(1998), 14(3), 337-344
2. 研究の背景と経緯の概要
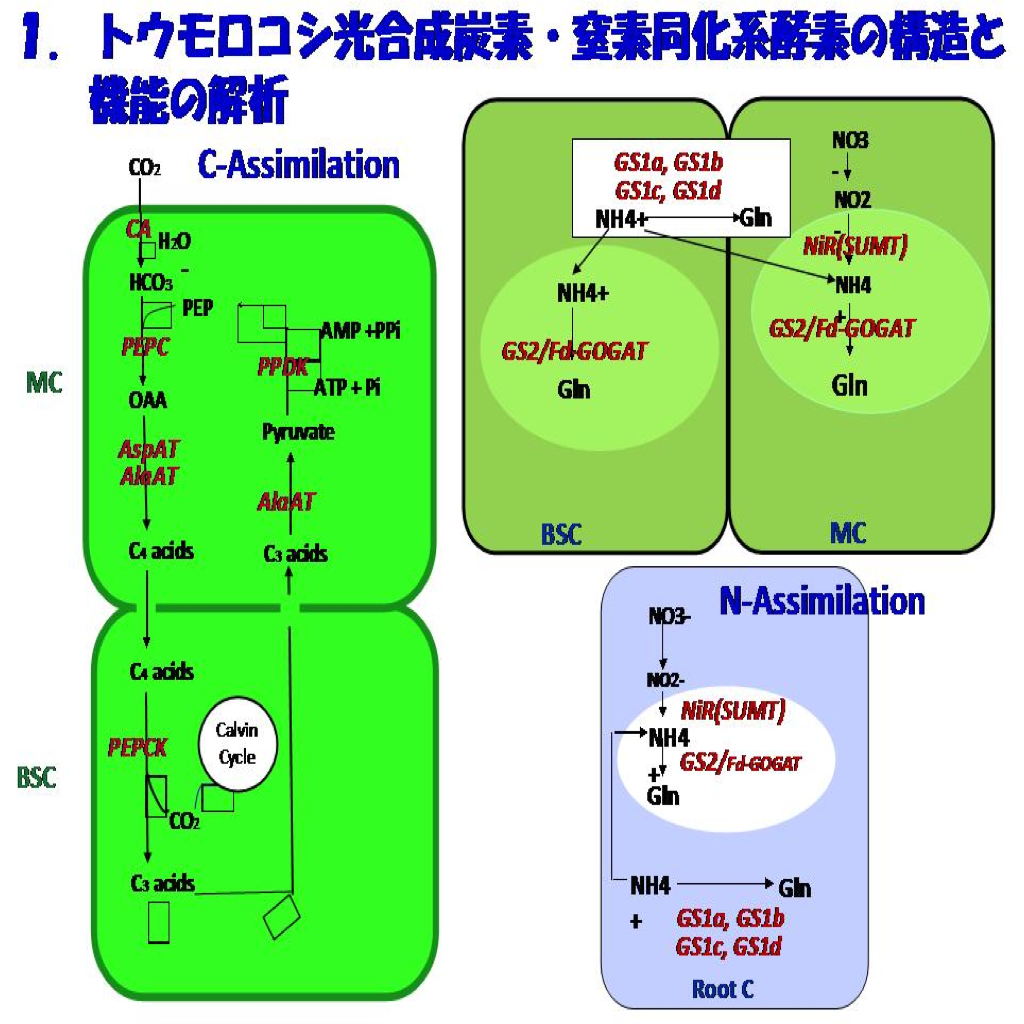
Johns Hopkins大医学部の生理化学研究室で酵素化学の手ほどきを得て帰国後始めた C4光合成酵素研究から紹介論文を手掛けるまでの26年間に行った私たちの研究の経緯を先ず紹介しましょう。一言でいえば、光・窒素に対する高効率を示すC4光合成の炭素・窒素同化系の酵素化学を柱に研究を進めてきました。その結果、C4サイクル酵素群の生化学的な理解をはじめ、それらの遺伝子および光・温度・窒素栄養に応答した発現、翻訳後の制御、細胞・組織・器官レベルでの局在性など、C4光合成の分子的成り立ちへの理解を深めることができました(図1)。
これら一連の研究の目標はC4植物における窒素配分とC/N制御の分子基盤の理解であり、その大部分の時間はその目標に至るプレーヤや解析手段つくりの準備についやしました。その目標が達成された暁には、温度や受光量が充足した下では窒素の利用効率が高いというC4植物の生理・生態的な特性の分子基盤を明らかにすることになるし、葉のタンパク質の80%近くにもなる多量な窒素の配分のしくみの理解にも繋がると考えました。そのためには、光合成の理解を単に葉肉細胞レベルに限らず、組織・器官、さらには個体レベルへと深めなければなるまいと考え始めていました。それは大河小説を頭に描くようなものでした。その挙句、多くの学生や協力者に恵まれ、私たちの研究はこの生理・生態的なC4植物の特性を分子レベルで追及するための手立てをほぼ整えてることができました。生化学・分子遺伝学を軸に展開し、これをもとに分子生理学の入り口にたどり着いたことになります。
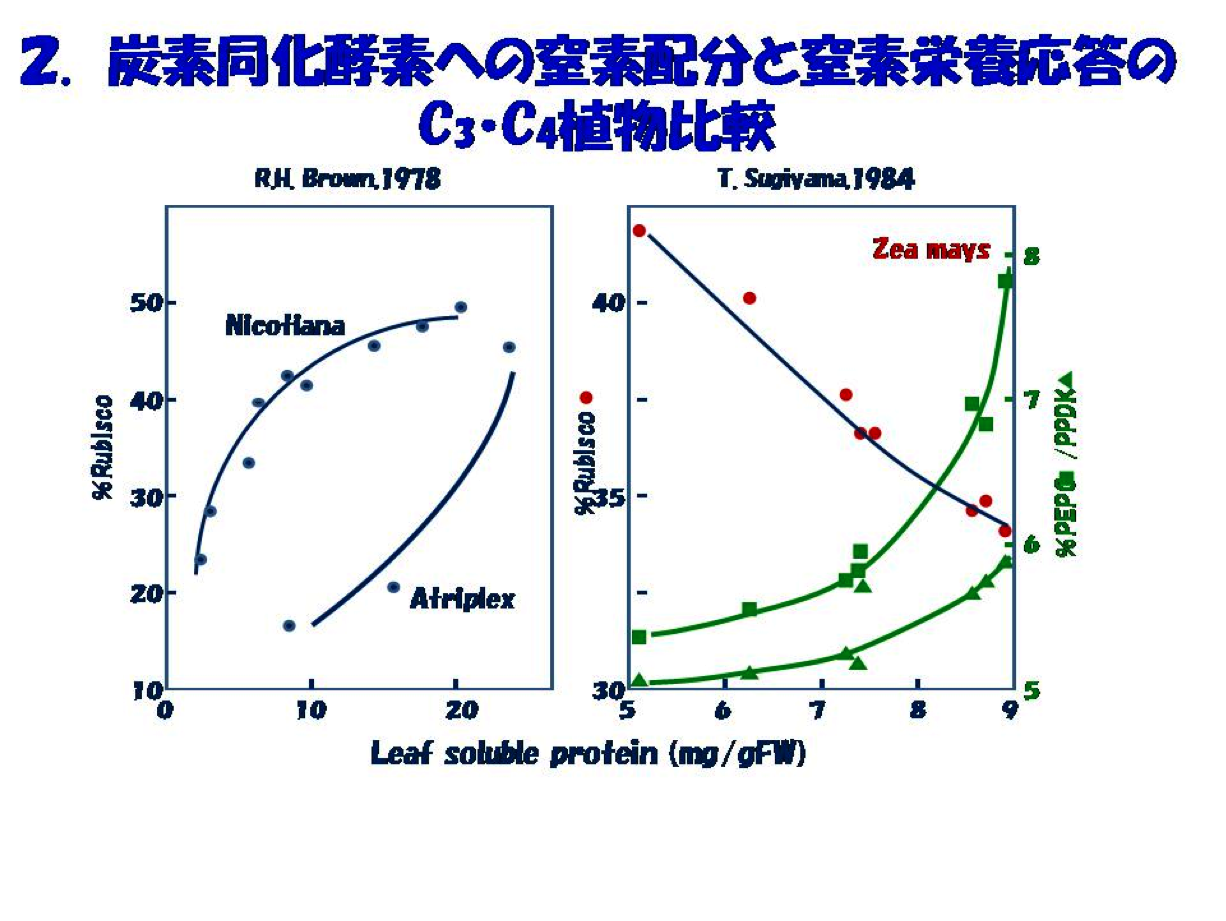
この考えに基づいた初期の研究にはインドネシアからの留学生Bambang Sugiharto 氏(現Jember University 教授)が活躍しました。そのきっかけは、我々が手掛けてきたC4炭素同化系酵素への窒素栄養応答をC3植物の炭素同化酵素Rubiscoと比較することでした(図2)。既に記載されているタバコやアカザ(C3植物)ではRubiscoのタンパク占有率は窒素栄養に応答し増大します。ところが、トウモロコシではRubisco占有率は葉の窒素量に応答して低下し、PEPC(PEPCase)とPPDK(pyruvate,Pi dikinase)の占有率はC3植物のRubiscoと同様に、葉の窒素量に応答して増大することがわかりました。この特性はトウモロコシ以外のタイプの異なるC4種Panicum miliaceumやEleusine coracanaでも同じでした。この事実からC4植物ではCO2濃縮ポンプに窒素が優先して配分されると理解しました。また、植物の生育を律速し、貴重な窒素源を葉タンパク質の大半を占めるC4サイクル系酵素に優先投資することは、C4CO2濃縮ポンプ機能が生育の律速代謝要因であり、この窒素の偏向配分を可能にする秩序があるに違いないと考えました。
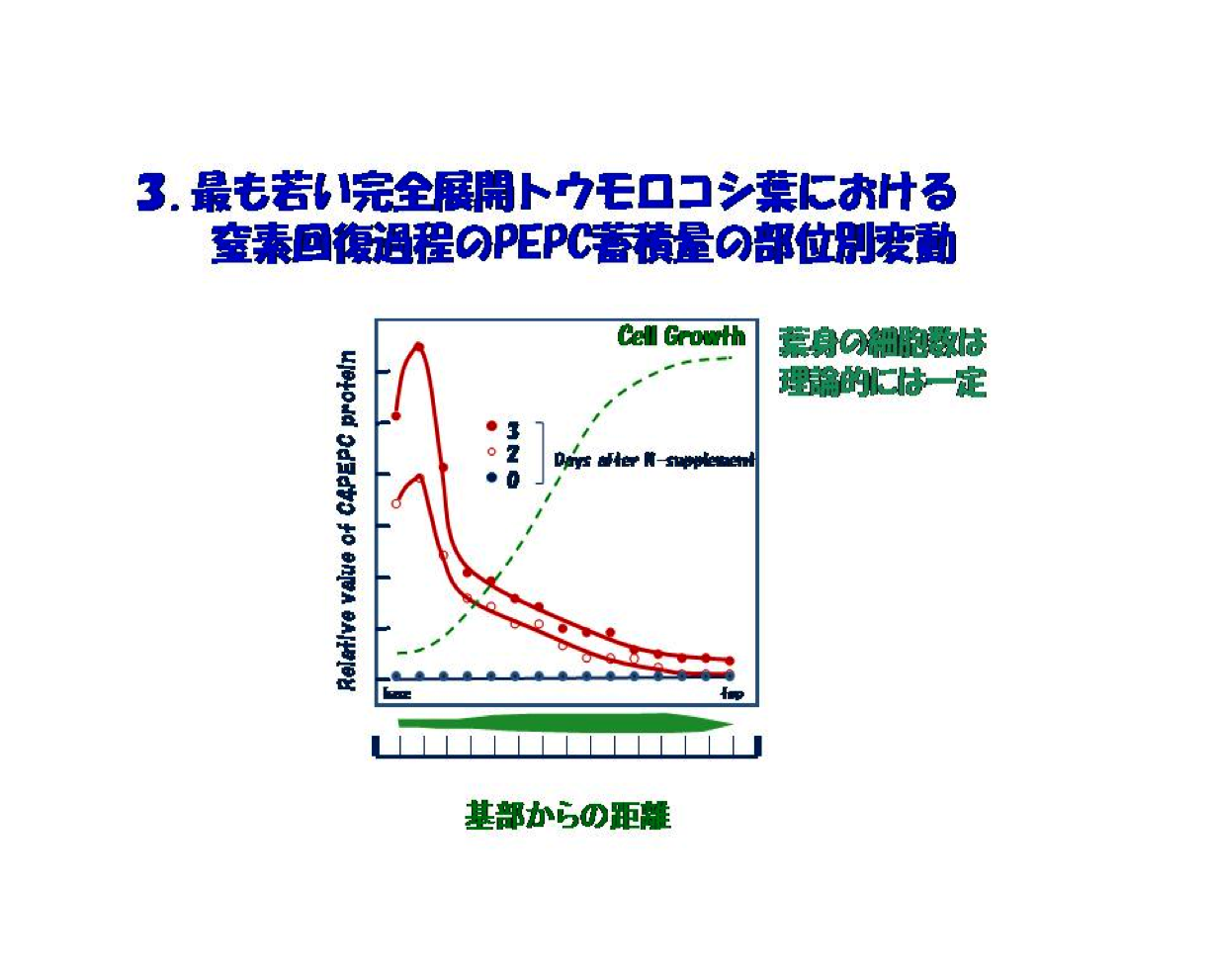
C4植物におけるこの窒素制御の仕組みを解明するために、より確かな実験系を組むことが重要であると考えました。つまり、従前のように葉全体、それも令の異なる葉を対象にすれば、令についても多様な細胞集団ですから分析値は平均化されてしまい、確度が高くしかも精密な実験結果を得るには困難です。考えあぐねた末、まず一定の個葉に着目し、細胞の令が基部から先端にかけ指数的に増す単細胞固有の細胞配列に着目し、部位に応じた窒素配分の動向をみることにしました。
具体的には、窒素欠乏ストレス下で生育した幼殖物の完全に展開した最も若い葉の細胞増殖の方向、すなわち基部から葉端にかけて窒素ストレスからの回復過程でのPEPCやPPDKなどC4サイクル酵素群の動向を調べました。明らかになったことは葉の基部でそれら酵素の優先的蓄積が最大に増幅されるということでした。この葉での細胞の成長は基部から先端にかけて進みます。ですから、基部から先端への距離は、単細胞の増殖曲線における時間に相当します。言い換えれば、この葉での細胞成長は単細胞生物の培養曲線と同じ様相にあります(図3)。この解析系はコロンブスの卵のように、後になってみれば当たり前ですが、生化学を軸に物取りからスタートした私には洗脳をもたらしました。このPEPCを一例とするin vivo実験系に加え、解析の道具立てとなる当時少しずつルーティン化し始めた遺伝子クローニングなどの分子遺伝的手法、それに葉肉細胞単離核を用いたrun-off assay法によるC4サイクル酵素遺伝子発現解析法を新たに確立しました。
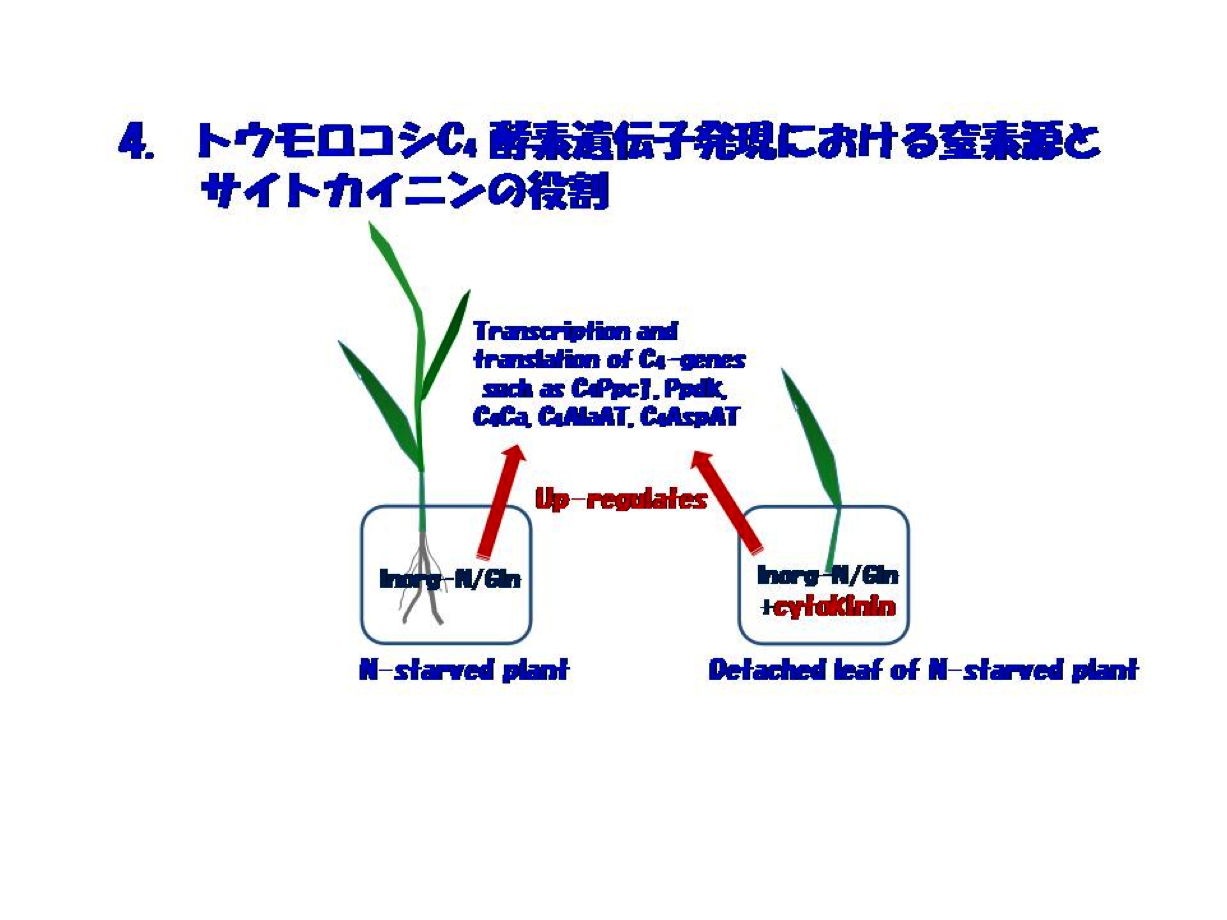
窒素依存のC4酵素遺伝子発現の仕組みを追う上で、重要な発見は窒素欠乏切り取り葉での窒素回復過程を追うことによってもたらされました。それは、「窒素ストレスにある個体では無機窒素またはGlnを加えれば、PEPC・PPDKをはじめC4サイクル系の酵素遺伝子の転写・翻訳は正に制御されますが、切取り葉ではこれら窒素源に加えサイトカイニンが不可欠である」ということでした(図4)。窒素源とサイトカイニンの役割の実態は当時卒論生であった鈴木石根さん(現筑波大学准教授)らにより、C4酵素PEPCとPPDK遺伝子の転写はサイトカイニンに依存し、窒素源はmRNAの蓄積と翻訳に必須であるということが明らかにされました。この一連の研究の引き金を引いたBambangさんによって、意外にもホルモンであるサイトカイニンとの出逢いが始まりました。
当時、サイトカイニンが光合成や葉緑体の発達をはじめ細胞分裂サイクル、セネセンス、それに栄養代謝にかかわる遺伝子発現制御の事例が増加しつつありました。それらの遺伝子には転写に関わるPol1、セルサイクルのCycD3、光合成では我々の知見も含めCab、Nit、C4Ppc1、Pdk、C4Ca、rbcS、それにフラボノイド合成系の酵素遺伝子Chs、Chi、Dfrでした。でも、これらの知見はいずれもサイトカイニンの生理的研究の域を出ず、情報伝達への足がかりには達していませんでした。この状況を打破した研究が現れました。当時(1996年)柿本辰夫氏によるシロイヌナズナでのサイトカイニン受容体と目されるCKI1の同定です。このホルモンの情報伝達研究の発展に扉が開かれようとしていました。
さて、前置きが長くなりましたが、サイトカイニンの分子生理学的研究のカギとなったのが紹介論文にある成果でした。
3.紹介論文の概要
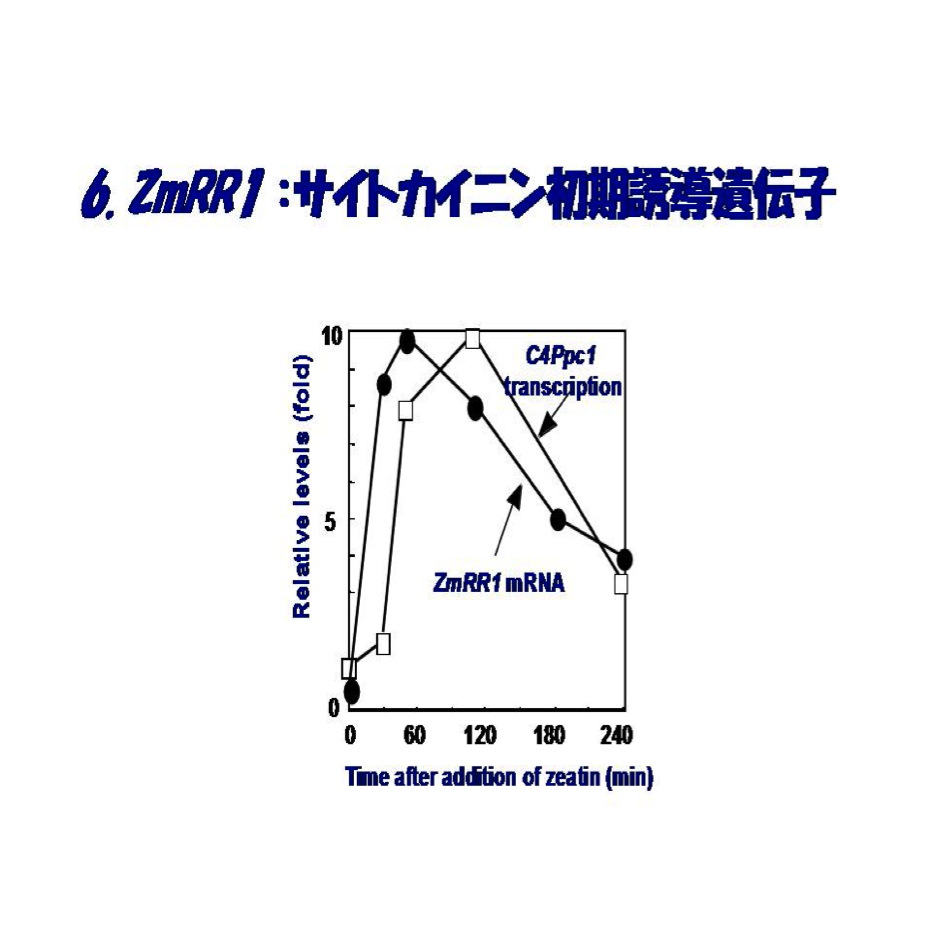
試みたのは、先ずトウモロコシにおけるサイトカイニン初期応答遺伝子の探索です。方法は当時開発されたdifferential displayです。具体的には、窒素欠乏下のトウモロコシの切取葉を5μM t-zeatin添加し、45分と90分後に全RNAを抽出し、t-zeatin無添加のものとdifferential displayで比較しました。担当したのは当時卒研生の鈴木めぐみさんでした。彼女の几帳面さと粘り強い努力の結果、t-zeatinに正の応答をする遺伝子の全鎖長クローンを得ることができました。ZmCip1(Zea maize cytokinin inducible protein 1)と命名しましたが、後にZmRR1としました。この遺伝子産物タンパク質は157アミノ酸からなり、サイズは16.7kDaであす。驚いたことに、このタンパク質はバクテリアの情報伝達系として知られているHis-Asp phosphorelay transduction(2成分情報伝達系)のresponse regulatorホモログであることがわかりました(図5)。
これを契機に、バクテリアHis-Asp phosphorelay transduction研究の第一人者である同僚の水野猛教授とのコラボレーションが始まりました。この遺伝子の転写産物は窒素欠乏植物の切取葉にサイトカイニンを添加することによって、標的遺伝子の一つと目されるPEPCに先んじて速やかに誘導され(図6)、その蓄積誘導は生理的なサイトカイニン濃度(10-9M ~10-7M)内で完全に濃度に依存すること、またサイトカイニン種としてt-zeatinのみならず、isopentenyladenosin (iPA)やisopentenyladenosine-5'-monophospahte (iPMP)によっても起きることが判明しました。ZmRR1の誘導には新規のタンパク質の合成を要しないことも分かりました。この発見は研究室に気分高揚をもたらしましたが、後に分かったことですが、我々だけの発見ではありませんでした。奇しくも、ほぼ同じころ米国のJ.J. Kieberのグループがバクテリアのresponse regulatorと類似したサイトカイニン誘導の2遺伝子をシロイヌナズナで同定に成功しました(1998, Plant Cell)。論文として公表されたのは1-2ヶ月われわれが先んじましたが、異なる植物でサイトカイニン初期応答性誘導のresponse regulatorの同定に2つの研究室が成功したわけです。
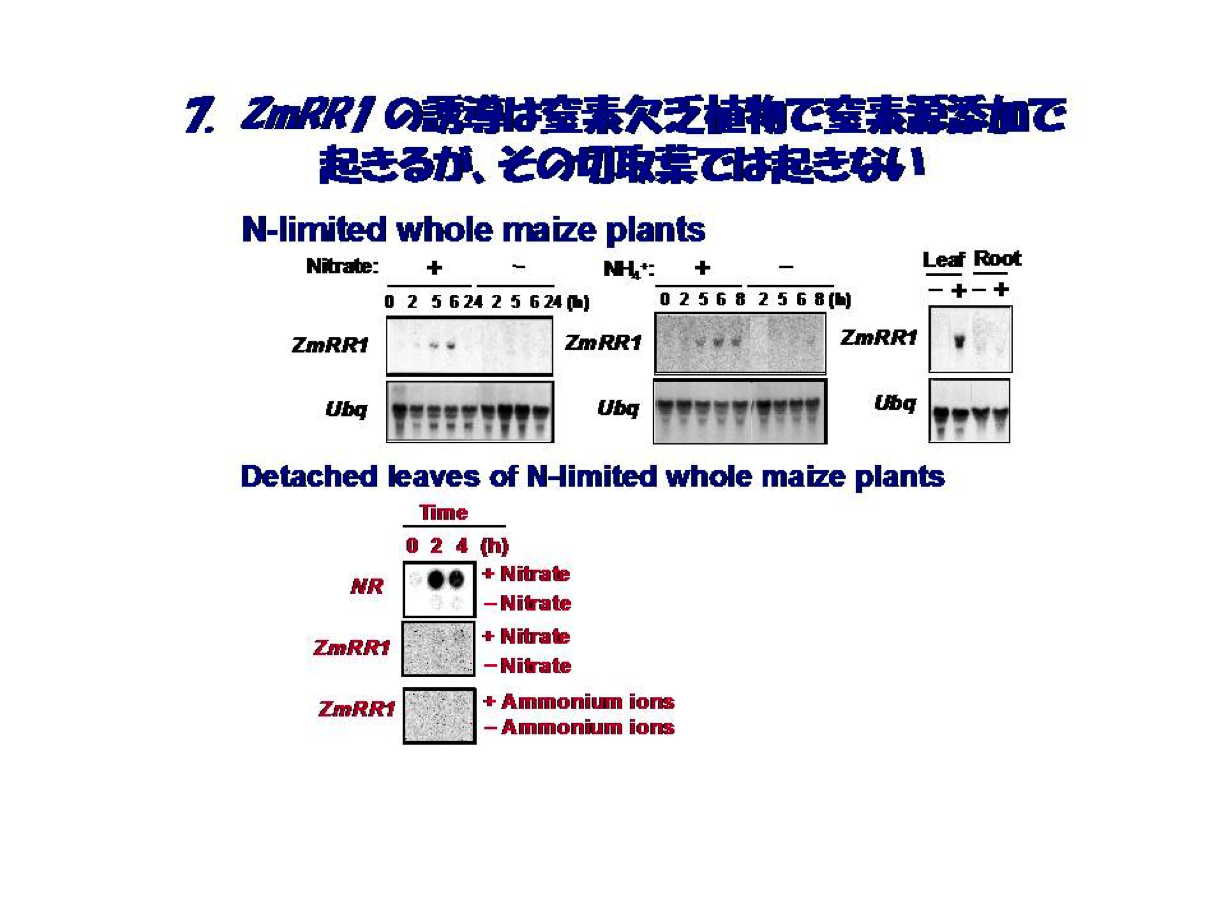
さて、ZmRR1の誘導で大きな関心は切取葉に替わって個体ではどうなるかということでした。当時の生理学的知見によれば、サイトカイニンは根でつくられるとの定説があり、我々はこのホルモンが窒素栄養の内部シグナルであろうと踏んでいました。そこでこの仮説の成否を確かめるべく、窒素欠乏下でのトウモロコシ個体に硝酸イオンまたはアンモニウムイオンを窒素源としてZmRR1の誘導の有無を調べた。思惑は見事に的中しました。いずれの窒素源も葉で添加後数時間でZmRR1の誘導が認められました(図7)。このZmRR1の誘導はrecombinant ZmCip1に対する特異抗体によりタンパク質の蓄積をもたらすことも判明しました。
作業仮説”サイトカイニンは窒素源に応答するトウモロコシ遺伝子発現における根から葉への内部シグナルである”の検証をすべく、窒素回復過程における根でのサイトカイニン量の動向を調べました。この解析は当時大学院生の武井兼太郎さんの一途な努力と工夫によって見事に成し遂げられました。窒素源として硝酸イオンを添加して2時間後に根のiPAもしくはそのリン酸体の濃度は0.89 (pmol g-1 fresh wt)から11.0 (pmol g-1 fresh wt)へと目覚ましく増加することが分かりました。
この論文における主要な成果は以上ですが、我々にとっては長年続けてきたC4サイクル酵素遺伝子発現とホルモンとしてのサイトカインの分子的な出会いとなった。これを契機に私達が展開した研究について以下に紹介します。
I. ”サイトカイニンは窒素源に応答する光合成遺伝子発現における根から葉への内部シグナル”であるとする概念の検証
葉で誘導されるZmRR1が本当に根で窒素源によって誘導合成されるサイトカイニンによって起きるのかどうかを先ず確かめることにこだわりました。そのため、窒素欠乏のトウモロコシ個体に窒素を補てんしたものとしないものそれぞれから道管液を採取し、それら各々に窒素欠乏個体の切取葉を浸漬し道管液を吸収させました。その結果、ZmRR1は窒素補てん植物の道管液に浸漬した切取葉だけに誘導され、しかもその誘導はサイトカイン抗体で処理すれば生じないことが分かりました。このことから、根で窒素源によって誘導されたサイトカイニンが道管を運ばれ、葉でZmRR1を発現誘導することが明らかになりました。
Response regulatorをはじめとするHis-Asp phosphorelay transductionの研究はトウモロコシで進めるとともに、水野猛教授の研究室ではシロイヌナズナを使って進められました。その結果、バクテリアの2成分情報伝達系がトウモロコシやシロイヌナズナでも機能していることが明らかになりました。図8はトウモロコシで私たちが同定したHis-Asp-relay 成分の一覧です。サイトカイニンレセプターやHis-containing phosphotransfer (HP)はサイトカイニンとは無関係に恒常的に発現していますが、response regulatorはサイトカイニンで誘導されるものとされないものに二分されます。
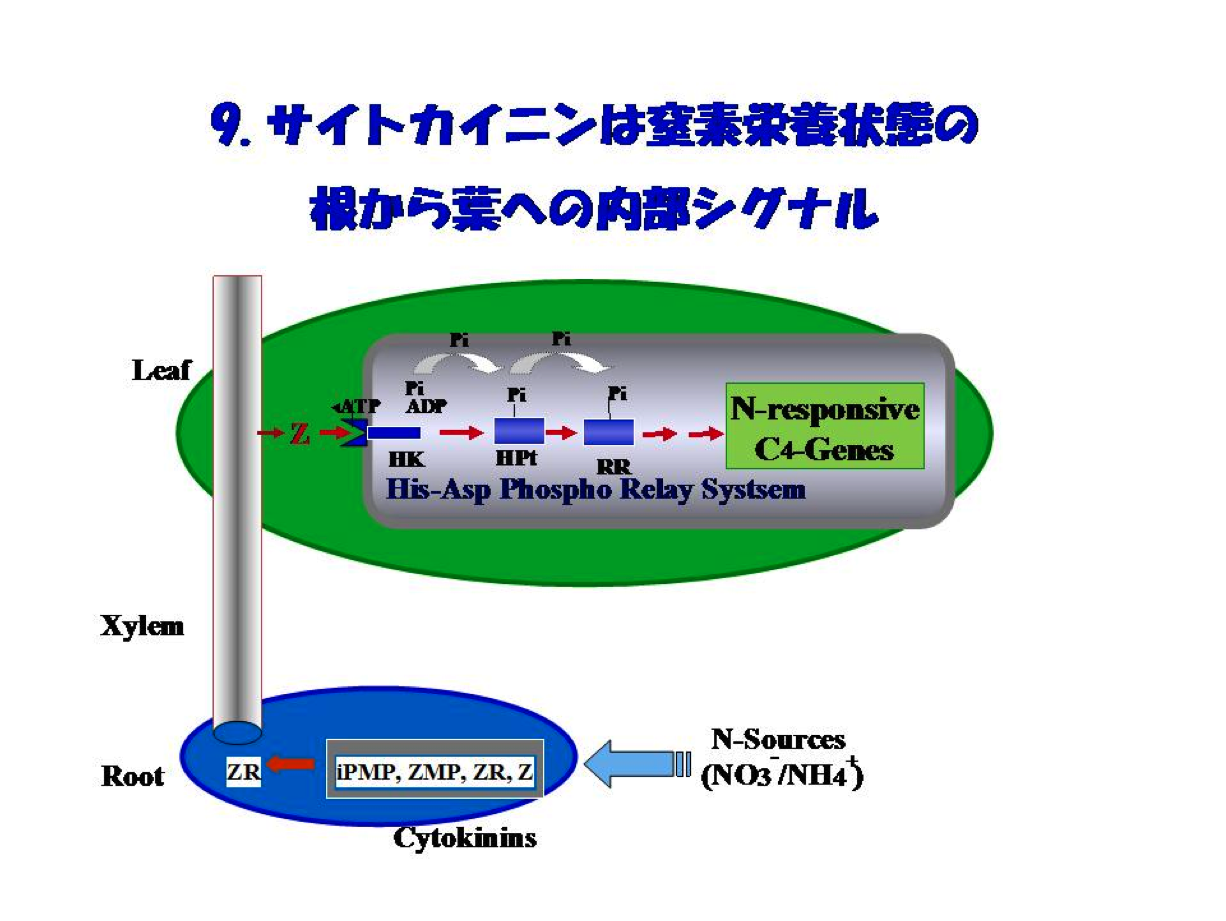
これら一連の成果をもとに、PEPCやPPDKなどのC4光合成遺伝子発現の窒素による制御のしくみを解析し、”サイトカイニンは窒素栄養の根から葉への内部シグナルである”と結論し、図9にある新しい概念を提唱しました。”酵素研究の果てにサイトカイニンとの出会いがあった、あるいは、たどりついた”ことになります。
さて、”C4植物がCO2濃縮ポンプに優先して窒素配分する”ことに話を戻しましょう。タンパク質への窒素配分には転写と翻訳が両輪となります。サイトカイニンに依存し転写されたC4光合成遺伝子、その翻訳にはバルキーなるがゆえに多量の窒素源が必要です。サイトカイニンをその内部シグナルとするということは窒素源が利用できることですから、多量のエネルギーを要する転写それ自身にも無駄なくして翻訳に繋がる筈です。このように考えると、C4光合成遺伝子はその発現にサイトカイニンをシグナルとしたことが他に優先して窒素配分を受ける要因となったのかも知れません。トウモロコシで得られた”サイトカイニンは窒素栄養の根から葉への内部シグナルである”との仮説が他の植物にも敷衍されるか否かが次の課題になりました。結論的にはイネやシロイヌナズナにおいてもあてはまることがその後榊原均さんらによって明らかにされ、根で窒素源に応答して発現が促進されるIPTfamilyの遺伝子が特定されました。また、この論文完成後で忘れえぬことは、このホルモンの合成系酵素の探索に学位取得を賭け粘り強く頑張った武井兼太郎氏とそれを後押した当時の助手榊原均さんらの努力です。多くの研究者が手を尽くした挙句にその初発合成酵素遺伝子すら検出できないということで、”植物はサイトカイニンを合成しないのでは?”と考える人も出始めたにもかかわらず、isopentenyltransferase遺伝子をシロイヌナズナで同定することに成功しました。これについても、奇しくも、ほぼ同じ時期に柿本辰夫氏のグループがシロイヌナズナからこの酵素遺伝子を同定しています。植物でのresponse regulator遺伝子といい、またシロイヌナズナでのisopentenyltransferase遺伝子の同定がそれぞれ2つの研究室で成功したことは先端の研究に独走は困難であるという教訓を教えられるとともに、それら遺伝子の発見が触れなば落ちんところにあったことを示すのであろうと思います。
私の研究生活は実質的にこのあたりで終止符をうつわけですが、サイトカイニンを巡るその後の著しい研究の展開は皆さんがご存知かと思います。
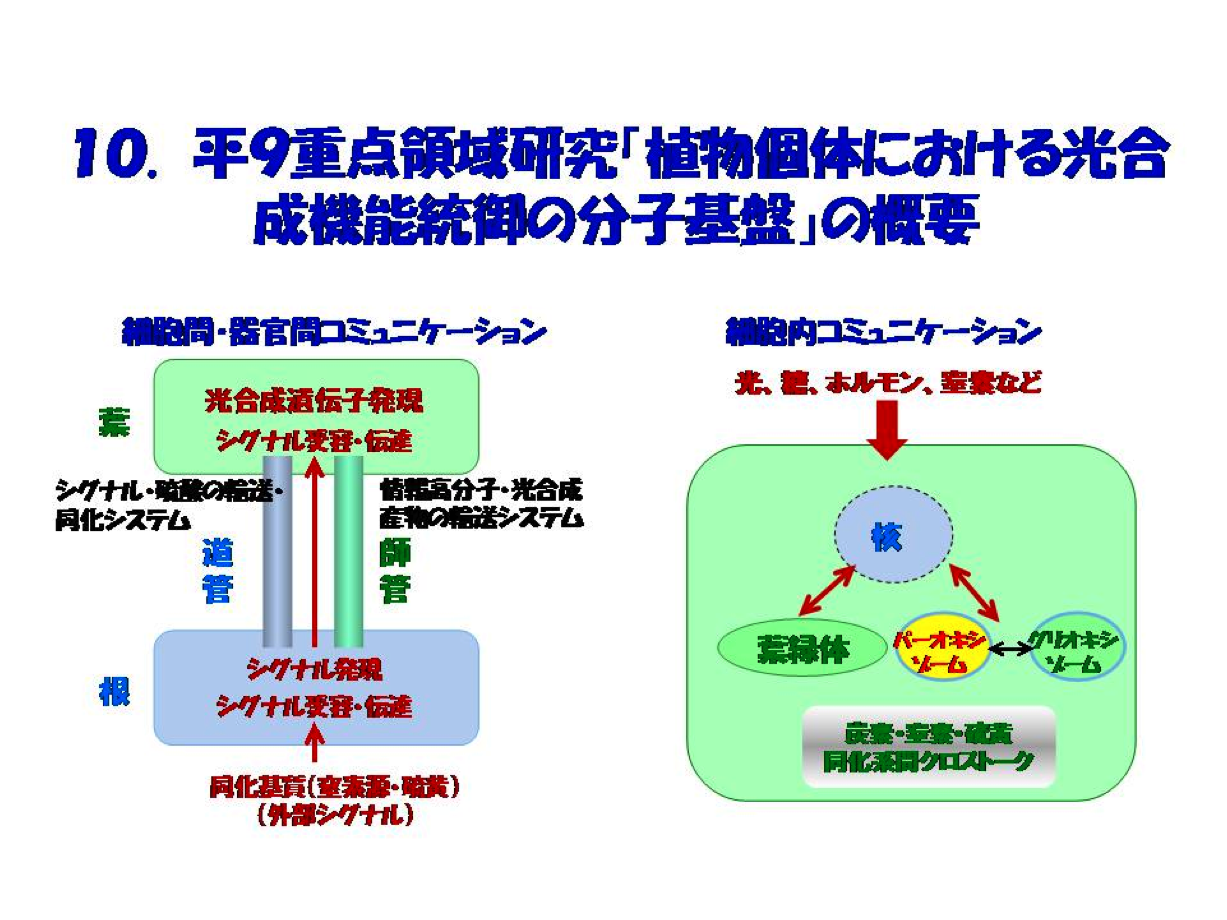
II.平成9年度重点領域研究「植物個体における光合成機能統御の分子基盤」の立上げ
研究の経緯を経てたどり着いた考えは「光合成を細胞内間での物質を介したコミュニケーションを理解する」ことの必要性でした。大雑把に云って、光合成の仕組みについて当時理解が進んでいたのは”個々の反応とそのシステムの概要であり、端的には光合成マシンを構成する主要な情報高分子”であり、その遺伝子がいくつか同定され始めました。これに対し、理解が得られていない最たることは植物個体での統合的・総合的理解、つまり個体レベルでの光合成統御とそのコミュニケーションの実態でした。そのため、標記研究の申請に際し提案したのは2つの計画班でした(図10)。私たちの研究室では、紹介論文の成果を軸にして外部シグナルとして同化基質窒素源が受容・伝達され、いかにして光合成遺伝子発現をもたらすかの解明に焦点をあてた研究を進めました。その成果の概要はIに述べたことです。
研究を離れた現在でも、植物の機能を分子に基盤を置いて細胞下から高次系へと統合することは植物科学発展に不可欠な視点と信じます。この分野の研究の発展を願って止みません。